¿Qué es el agua?
El agua por definición es una sustancia que en su estado más puro es insípida, incolora e inolora con un pH neutro o de 7; pero generalmente se encuentra disuelta con ciertos minerales, sales y residuos orgánicos que cambian su sabor, color, olor y pueden llegar a modificar su pH. Es la única sustancia que se encuentra en nuestro planeta de forma natural en los estados sólido, líquido y gaseoso, y es indispensable para el desarrollo y sostenimiento de la vida en el planeta pues la gran mayoría de seres vivos se componen de ella y la necesitan para realizar procesos como el transporte de nutrientes, la digestión de alimentos, la regulación de la temperatura corporal, entre otros. Es por esto que al buscar rastros de vida en otros planetas de nuestro universo, los astrónomos se interesan en indicios que puedan evidenciar la presencia de agua en estos mismos, pues el agua y la vida van ligadas de la mano.

El ser humano ha estado en contacto desde sus orígenes con el agua pero no fue hasta finales del siglo XVIII, de manos del químico británico Henry Cavendish, el cual descubrió que el agua no era un elemento sino una sustancia. Años más tarde, retomando el trabajo de Cavendish, el químico Antoine Laurent de Lavoisier descubre los elementos que componían a la molécula de agua, el hidrógeno y el oxígeno; y en 1804, el químico francés Louis Joseph Gay-Lussac y el geógrafo prusiano Alexander Von Humboldt descubrieron que por cada 2 volúmenes de hidrógeno una molécula de agua tenía 1 volumen de oxígeno. Actualmente el agua sigue siendo objeto de estudio pues su vital importancia y el desconocimiento que aún tenemos de ella impulsa estas actividades.
Composición del agua
La molécula de agua está compuesta de dos átomos de hidrógeno y uno de oxígeno, con la fórmula H2O. Estos dos átomos de hidrógeno comparten cada uno un electrón con el átomo de oxígeno, lo cual genera un enlace covalente.
Mediante diversos análisis de tipo espectroscópico y de rayos X se determinó el ángulo de enlace entre el oxígeno e hidrógeno, el cual es de 104.5°. También se ha logrado aproximar una distancia promedio entre los átomos de oxígeno e hidrógeno, la cual es de 95.84 pm ó 0.9584 Å.

Naturalmente el oxígeno tiene una alta electronegatividad, es decir, una alta capacidad de atraer los electrones compartidos en el enlace, lo cual causa que alrededor de este átomo de oxígeno se genere una carga parcial negativa y alrededor de los átomos de hidrógeno se genere una carga parcial positiva. De esta forma, la molécula de agua es una molécula polar, pues tiene una parte cargada positivamente y la otra cargada negativamente, aunque la carga general de la molécula sea neutra. Gracias a esta polaridad, el agua goza de variadas características fisicoquímicas.

Características y propiedades del agua
El agua posee una gran variedad de propiedades y características que la hacen una sustancia única en nuestro planeta. A través de estas se pueden entender los variados fenómenos que sobre ella toman lugar y que influyen de una importante manera en cómo se ha desarrollado la vida en el planeta hasta nuestros días.

Puentes de hidrógeno y cohesión del agua
Gracias a la polaridad de la molécula de agua se generan puentes de hidrógeno. Un puente de hidrógeno es una manifestación de la fuerza molecular que se origina tras la atracción entre un átomo con una cualidad electronegativa y un átomo de hidrógeno con una carga parcial positiva que se encuentre en enlace covalente con un átomo electronegativo. En el caso del agua, el átomo electronegativo que permite la creación de los puentes de hidrógeno es el oxígeno que se atrae con el hidrógeno. Este tipo de fuerza de atracción no se debe comparar con un enlace pues es hasta 20 veces más débil que este mismo. Sin embargo, es muy importante pues permite que se genere una cohesión entre las moléculas de agua, que se ve reflejada en su facilidad para agruparse y mantenerse unidas, pudiéndose comprobar al dejarse caer gotas de agua sobre un vidrio, las cuales van a tender a agruparse, a diferencia de las de alcohol que no lo harán. En el agua líquida, bajo una temperatura y presión estándar, cada molécula puede llegar a formar hasta 3.6 puentes de hidrógeno simultáneos, los cuales alcanzan una longitud aproximada de 0,2 nm.

En el agua líquida, bajo una temperatura y presión estándar, cada molécula puede llegar a formar hasta 3.6 puentes de hidrógeno simultáneos, los cuales alcanzan una longitud aproximada de 0,2 nm.
Densidad del agua
Tras el paso del agua al estado sólido, en el momento en el que las moléculas de agua forman los cristales de hielo, dejan un espacio vacío entre ellas. Este espacio vacío entre los puentes de hidrógeno genera que al cambio de estado la densidad disminuya y no aumente, el caso contrario a lo que ocurre comúnmente pues la solidificación de un líquido generalmente entraña el aumento de su densidad.

Esta particularidad permite desde cosas tan simples como que un hielo flote hasta sucesos esenciales para el mantenimiento de los ecosistemas terrestres, ya que permite la conservación de la vida acuática en las zonas del mundo en las que en el invierno se alcanzan temperaturas muy bajas que congelan los cuerpos superficiales de agua, pues esta disminución de la densidad permite que se genere en el cuerpo de agua una capa superficial de hielo y debajo de esta capa el agua conserva una temperatura estable que permite el mantenimiento de la vida acuática.
Tensión superficial del agua
La alta fuerza de cohesión existente entre las moléculas de agua es la responsable de la tensión superficial en esta. La tensión superficial se da cuando el agua reduce su superficie pues la fuerza que afecta a todas las moléculas presentes en el agua no es la misma, así las moléculas que se encuentran en el interior del líquido tienen un nivel de energía menor que las que se encuentran en el exterior de este pues al estar rodeadas completamente por moléculas las fuerzas atractivas se compensan, caso contrario al de las moléculas en la superficie pues no están rodeadas completamente.

El agua tiende a reducir su nivel de energía total, esto lo logra al disminuir el número de moléculas con un alto nivel de energía en la superficie. De esta forma las moléculas exteriores se empiezan a atraer con mayor fuerza y se reducen las curvaturas presentes en la superficie del agua; lo cual le da una gran resistencia a la rotura tras ser sometido a estrés o tensión. Esto es aprovechado por seres como el insecto zapatero, algunas especies de arañas y algunas especies de basiliscos para movilizarse por el agua.

Adhesión del Agua
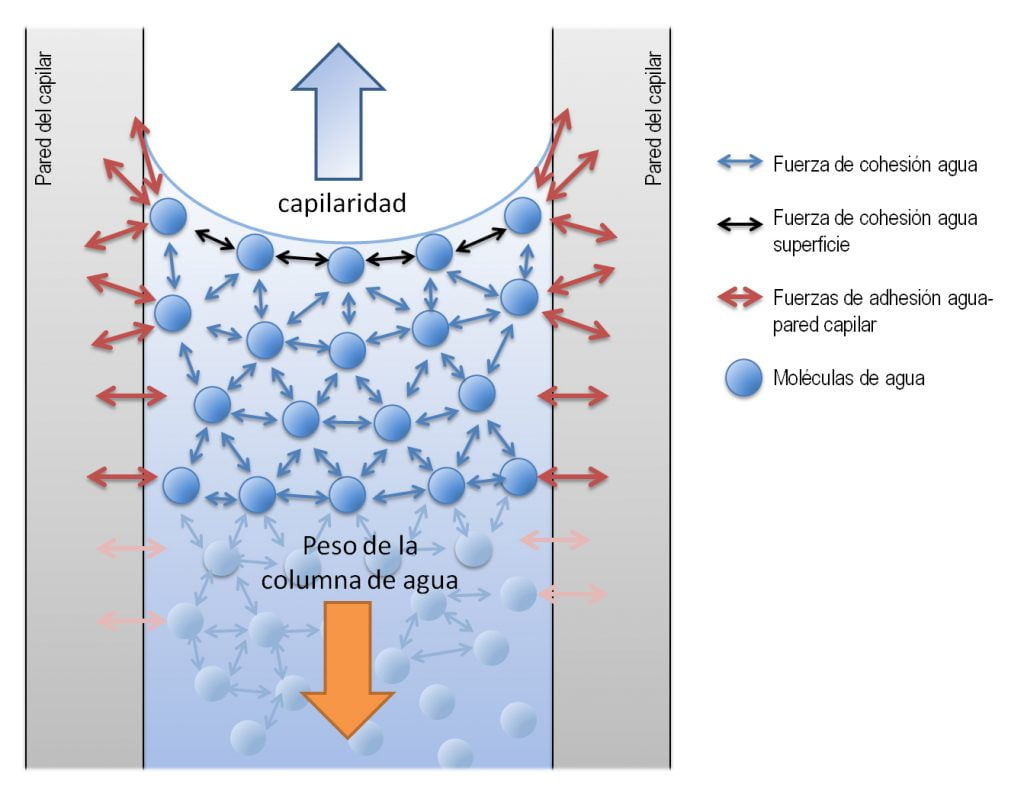
Se define adhesión como la atracción que existe entre moléculas de dos tipos diferentes. En el caso del agua, la presencia de moléculas cargadas positiva o negativamente en el material al que se adhiere reincidirá en la eficacia de la adhesión. Al ocurrir esta adherencia del agua a una superficie de material adherente que se encuentra reforzado por la polaridad sus moléculas, las moléculas de agua prefieran fijarse a este material polar y no a otras moléculas de agua, teniendo así lugar la capilaridad.

La capilaridad es definida como la capacidad de un fluido de tanto bajar como subir a través de un tubo capilar, esta capacidad depende también de la tensión superficial del líquido, que a su vez se relaciona con la cohesión molecular del fluido. La capilaridad está presente en el agua y es esencial para el correcto desarrollo de diversos procesos esenciales como el transporte de agua, sales minerales y otros nutrientes desde las raíces de las plantas a sus hojas. Esto ocurre en lo que parece ser una “aparente” rotura de las leyes de la gravedad, pero es sencillamente explicado pues las paredes del tejido conductor encargado de esto, xilema, son propicias para una correcta adhesión por parte del agua, que igualmente gracias a su cohesión molecular se transporta desde la base hacia los extremos de una planta de forma natural, posibilitando así la existencia de esta.
Solvencia del agua
El agua es conocida como el solvente universal pues es el líquido con mayor capacidad de solvencia en todo el planeta. Las sustancias fácilmente solubles en agua se conocen como sustancias hidrofílicas; estas clases de sustancias tienen la característica de ser polares o ser compuestos iónicos, en estos casos la polaridad y la ionización de estas moléculas les facilita romper las fuerzas de cohesión del agua, deshaciendo los puentes de hidrógeno ya establecidos y generando nuevas uniones con las moléculas polares o iónicas, mezclándose así fácilmente en estas sustancias.

Las sustancias hidrofóbicas son todo lo contrario, estas sustancias son incapaces de deshacer los puentes de hidrógeno que genera el agua y de esta forma no se pueden mezclar con ella. Estas sustancias carecen de moléculas polares o ionizadas, así las fuerzas cohesivas del agua son lo suficientemente fuertes como para empujar a estas sustancias afuera de ella, rechazando una unión.

Esta propiedad disolvente del agua la hace ser ideal para la realización de diversas funciones corporales. Entre ellas contaríamos la de la filtración llevada a cabo por los riñones y que da como resultado la eliminación de residuos mediante la orina. De igual forma cabe resaltar que un ser humano promedio se compone en un 50 a 70% de agua, teniendo un menor porcentaje las mujeres pues tiene una mayor cantidad de tejido adiposo (tejido encargado de almacenar agua). Además prácticamente todos los líquidos corporales usan como solvente el agua y partes esenciales del organismo como el corazón, la piel, la sangre, los pulmones, los músculos y el cerebro se componen en su mayor parte de agua, constituyéndose así en un líquido esencial para nuestra existencia y la de la gran mayoría de seres vivos.

Alta capacidad calorífica específica o punto de calor específico
Antes es importante entender la diferencia entre calor y temperatura, el calor es una forma de energía que se expresa en Joules y la temperatura es una forma de describir qué tan frío o caliente está un objeto, expresándose en grados Celsius.
Se define a la capacidad calorífica específica o al punto de calor específico como la magnitud física que implica la cantidad de calor que un kilogramo de una sustancia necesita absorber para elevar su temperatura en un 1°C.

El agua tiene un alto punto de calor específico, por esto su temperatura es más difícil de elevar que la de otros líquidos o incluso metales, pues se requiere una mayor cantidad de calor para hacer esto; así se necesitan 4148 julios para aumentar en 1 kg de agua la temperatura en 1 °C, en cambio para hacer lo mismo con 1 Kg de plomo se necesitan 130 julios y para hacerlo con 1 Kg de cobre se necesitan 385 julios.
Esta capacidad del agua de resistir a un cambio de temperatura explica el por qué, en verano, toda la zona alrededor de una piscina tiende a estar muy caliente mientras esta conserva una temperatura fría; o también por qué al ser puesta a una alta temperatura en una estufa, una tetera de aluminio vacía se empieza a fundir, mientras que llena de agua no le pasa nada, pues el agua absorbe el calor de una forma paulatina en la que el recipiente no sufre mayor daño.

Esto es clave en el mantenimiento y desarrollo de la vida marina; pues permite que la temperatura en lagos, ríos, océanos y demás se mantenga constante y de esta forma la fauna y flora propias de estos ecosistemas no se ven afectadas extremamente en los momentos de gran calor, por poner un ejemplo. Gracias a esto el agua también puede retener durante el verano parte del calor que le llega, y soltarlo al ambiente en invierno, regulando así la temperatura ambiental. Es así como la temperatura de lugares cercanos a grandes cuerpos de agua tiende a ser más estable que en lugares lejanos de cuerpos acuíferos.

La evaporación del agua y la termorregulación
La termorregulación es el equilibrio propio del cuerpo que se da por la constante ganancia y pérdida del calor, enfocado en mantener una temperatura estable y homogénea del cuerpo. La evaporación del agua es un tema crucial en la termorregulación de la gran mayoría de mamíferos existentes en el planeta e incluso de una gran cantidad de especies de plantas pues el exceso de la exposición a temperaturas altas sin ninguna clase de regulación puede causar daños y entorpecer diversos procesos de estos organismos.

El caso de la sudoración es un perfecto ejemplo de la termorregulación por evaporación. Cuando los receptores térmicos de la piel captan calor, esto hace que las moléculas de agua presentes en la misma se alteren. Esta alteración se da al romperse los puentes de hidrógeno ya existentes entre las moléculas de agua, lo que causa que el agua se evapore. Cuando el agua se evapora, además de eliminar líquido del cuerpo expulsa el calor que este recibió, generándose de esta forma un equilibrio térmico en el cuerpo sujeto a este proceso.
Conductividad eléctrica y dureza del agua
La conductividad eléctrica es la capacidad de permitir el paso de electrones que puede llegar a tener cierto material o sustancia. La conductividad eléctrica es mayor en metales; pero en este caso al ser el agua un líquido, su conductividad está dada por la presencia que puede haber en esta de sólidos disueltos como minerales o sales que la ionizan (TDS) y permiten así el paso de electrones a través de esta. La conductividad eléctrica en líquidos es medida gracias al uso de un conductímetro para captar la resistencia generada entre dos electrodos posicionados a una misma distancia dentro de la solución.

Prácticamente toda el agua que se encuentra en la naturaleza tiene sólidos disueltos en esta. Gracias a la presencia de estas sales y minerales cargados positiva o negativamente, electrolitos, el agua es capaz de hidratar al cuerpo humano, pues puede reponer los mismos electrolitos que se encuentran presentes en la sangre y son constantemente perdidos tras la realización de actividad física, entre otras actividades. Por esta razón, el agua destilada, de la cual se eliminan minerales y sales disueltos, no hidrata ni permite el paso de corriente eléctrica; al igual que el agua resultante de un proceso de ósmosis inversa, siendo en este caso necesario añadirle minerales para que el agua recobre sus facultades electrolíticas y conductivas.

Gracias también a la presencia de ciertos compuestos minerales en una cantidad de agua se puede establecer un parámetro de dureza del agua. La dureza del agua está dada por la suma de sales de magnesio y calcio y su presencia no representa ningún inconveniente en cuanto a su posible consumo o utilización, solo debiéndose tener en cuenta que se pueden formar incrustaciones calcáreas o cal en los recipientes contenedores, y que la efectividad de ciertos jabones y productos de limpieza podría llegar a verse reducida debido a una reacción entre los componentes.
El agua en el planeta Tierra
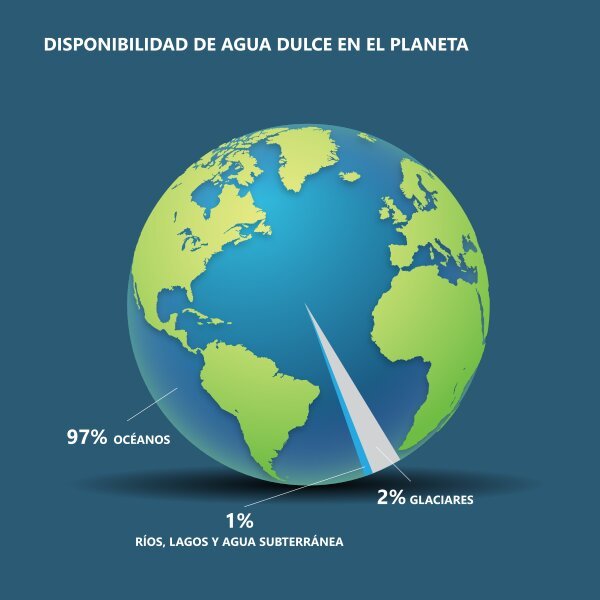
El agua es una sustancia esencial y muy importante de nuestro planeta tierra, pues este se compone en su gran mayoría de este líquido, en un 71%, siendo el 29% restante masa continental. De este 71%, el 96.5% es agua de tipo salada que se encuentra en los océanos y el 3.5% restante es agua dulce presente superficialmente en ríos, arroyuelos y lagos; de forma subterránea en acuíferos, redes subterráneas y pozos naturales, y en forma de hielo en los picos de las montañas y los glaciares presentes en los polos.

El porcentaje de agua dulce presente de forma superficial en el planeta es reducido en comparación al porcentaje de agua de tipo subterránea pues un poco más de 8.400.000 km3 del agua dulce presente en la Tierra se encuentra a más de un kilómetro por debajo de la superficie. Además en comparación con el agua que se encuentra en forma de hielo, el índice de agua líquida en el planeta es muy bajo, pues del 3.5% de agua dulce el 69% se encuentra congelada; esto supondría un aproximado de 29.200.000 km3 de agua los cuales se concentran en las regiones polares y Groenlandia. Todo esto sin contar el agua en forma gaseosa que se encuentra en nuestra atmósfera, la cual tiene un volumen aproximado de 12.900 km3, el cual se renueva constantemente gracias al ciclo del agua en el que se evaporan un estimado de 1.170 km3 de agua.
Aun así, si supusiéramos un caso hipotético en el que toda el agua del planeta estuviera en forma líquida se obtendría un volumen de más de 1.386 millones de kilómetros cúbicos de agua ó 1,386 x 1018 litros, esto claro incluyendo el agua en forma sólida presente en glaciares y casquetes polares, y en forma gaseosa en la atmósfera.
| Fuente de agua | Volumen de agua km3 | Porcentaje de agua dulce | Porcentaje de agua total |
| Océanos, mares y bahías | 1.338.000.000 | – | 96,54 |
| Casquetes polares, glaciares y nieve permanente | 24.064.000 | 68,6 | 1,74 |
| Agua subterránea | 23.400.000 | – | 1,69 |
| -Dulce | 10.530.000 | 30,1 | 0,76 |
| -Salada | 12.870.000 | – | 0,93 |
| Humedad de tierra | 16.500 | 0,05 | 0,001 |
| Hielo de tierra y permafrost | 300.000 | 0,86 | 0,022 |
| Lagos | 176.400 | – | 0,013 |
| -Dulce | 91.000 | 0,26 | 0,007 |
| -Salada | 85.400 | – | 0,007 |
| Atmósfera | 12.900 | 0,04 | 0,001 |
| Agua de pantanos | 11.470 | 0,03 | 0,0008 |
| Ríos | 2.120 | 0,006 | 0,0002 |
| Agua biológica | 1.120 | 0,003 | 0,0001 |
Por obvias razones, todos nosotros estamos llamados a cuidar de este líquido tan maravilloso e intrigante que es el agua. Sustancia que ha formado al planeta y la vida que este alberga, y que, sin lugar a duda, necesitamos para nuestra existencia. Así, el compromiso de cuidar el planeta y garantizarles a las futuras generaciones una buena calidad de vida se ve intrínsecamente relacionado con el cuidado constante y minucioso del agua.En Fibras y Normas de Colombia S.A.S. estamos comprometidos con el cuidado del medio ambiente y del agua; por esto fabricamos equipos de tratamiento de aguas residuales, potabilización de agua, entre otros, garantizando la mejor calidad de tratamiento en el mercado. Igualmente prestamos asesoría en asuntos de ingeniería ambiental y sanitaria apoyándonos en nuestro gran equipo de ingenieros y expertos que día a día se comprometen con la preservación de nuestro recurso más preciado, el agua.
Agua
-
Composición del agua(5)
-
Características y propiedades del agua(4.5)








